La synthèse d'énergie afin de garder une vitesse maximale
Introduction:
Après que le coureur ait acquis sa vitesse maximale, celui-ci a pour unique but de la maintenir jusqu’à la ligne d’arrivée. Pour cela il a besoin d’énergie (carburant de tout être) pour alimenter ses muscles.
Dans cette sous partie nous étudierons :
Premièrement : En quoi l’ATP est la molécule constituant l’énergie à travers l’étude de l’organisation et du fonctionnement des muscles.
Deuxièmement : Comment l’homme, par la chaine respiratoire et ces trois étapes (glycolyse, cycle de Krebs, phosphorylation oxydative), synthétise l’énergie.
Toutes ces études permettront de pointer comment l’athlète doit s’entrainer et aussi s’alimenter pour pouvoir garder le plus longtemps sa vitesse maximale.
1/ L’ATP constitue l’énergie car elle permet le mouvement des muscles:
a) L’organisation des muscles:
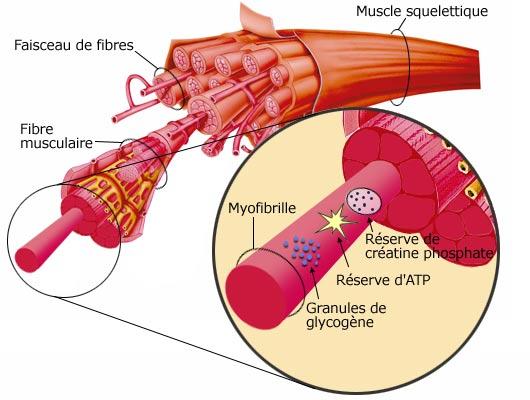
Les muscles squelettiques, c'est-à-dire, ceux fixés par des tendons sur des os, sont les muscles à l’origine des mouvements du corps. Ils sont composés de milliers de fibres musculaires dont la taille varie de 10 à 100 micromètres de diamètre et jusqu’à plusieurs centimètres de longueur. Il existe deux types de fibres les rouges et les blanches. Le premier type correspond à des fibres plus petites et plus lentes dont le sarcoplasme possède une grande quantité de mitochondries et de myoglobine (protéine permettant le transport de l’oxygène comme l’hémoglobine). Ces fibres vont ainsi être plus endurante comme nous allons le montrer par la suite. Le second type lui correspond à des fibres dites blanches qui possèdent une grande quantité de glycogène (groupement de glucose) et dont la longueur est bien plus importante, ainsi comme nous le démontreront ce type possède une plus grande capacité contractile.
Ces fibres sont la résultante de la fusion, lors du développement embryonnaire, de centaines de cellules, par conséquent elles sont composées de nombreux noyaux plaqués contre la membrane plasmatique(le sarcoléme) en raison de la place que prennent les myofibrilles.
En effet quasiment toutes les fibres sont occupées par des myofibrilles (longs cylindres placés parallèlement aux axes de ces fibres), leur diamètre ne dépasse pas 2 micromètres et elles font toute la longueur de la fibre. Les myofibrilles forment la partie contractile des muscles en raccourcissant leur taille simultanément.
Ce mouvement complexe met en jeu les sarcomères composants les myofibrilles. C’est la jointure des sarcomères au point Z qui donne la striation transversale caractéristique des muscles squelettiques. Les sarcomères sont composés, au centre de myofilaments épais appelés myosine et à l’extérieur de myofilaments fins d’actine se rattachant au point Z.
Un myofilament de myosine ( ou épais ) est constitué d’environ 200 molécules de myosine, celles-ci sont constituées de deux têtes rondes formant des sites de liaison et d’une tige. Dans le myofilament les têtes sont toujours situées vers l’extérieur.
Un myofilament d’actine ( ou fin ) est en fait constitué de 2 brins d’actine enroulés en hélice un peu comme l’ADN sauf qu’il n’y a pas de liaison faible entre les 2 brins. C’est la tropomyosine qui permet la solidification de l’ensemble. On a donc des myofilaments épais de myosine entourés par des myofilaments fins d’actine et cela dans chaque sarcomère. De plus une molécule est liée à l’extrémité de chaque molécule de tropomyosine, la troponine qui est constituer de trois chaines différentes :
• T liant la tropomyosine à la troponine.
• I inhibant la liaison actine-myosine en masquant le site de liaison de l’actine grâce à la molécule de tropomyosine.
• C fixant le calcium et levant l’action inhibitrice de la troponine I.
Schémas récapitulatifs:
1) Schéma d'un muscle squelletique:
2) Schémas d'un sarcomères:
 |
 |
| Figure 1A : Vue longitudinale d'un sarcomère | Figure 1B : Coupe transversale d'une myofibrille |
3) Myofilament d'actine:

4) Myofilament de myosine:
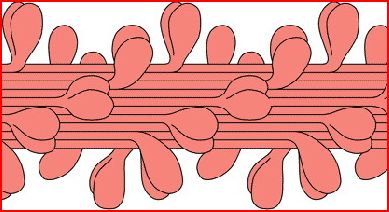
Les excroissances sont les têtes de myosine.
b) La contraction des muscles:
Tout d’abord la contraction musculaire ne se fait pas toute seule.
En effet un mécanisme complexe, qui met en jeu des vagues de protons et d’électrons, permet cette contraction : c’est la phase d’excitation .
Premièrement au niveau des neurones et plus précisément des synapses une molécule spéciale l’acétylcholine ouvre un canal cationique qui transfère des ions Na+ et k+ entrainant la dépolarisation de la membrane post synaptique c'est-à-dire qu’un coté de cette membrane au départ + devient - et que le phénomène inverse se produit en même temps de l’autre coté.
Puis cette dépolarisation au niveau des neurones se propage jusqu'aux muscles par la moelle épinière et les motoneurones en une vaste vague de dépolarisation sur le sarcoléme des cellules musculaires. Celle-ci va ouvrir des petites citernes les réticulums sarcopasmiques, à l’intérieur des cellules, qui contiennent un liquide à forte concentration de calcium. Il est vrai que lors de la dépolarisation on observe une augmentation par 1000 de la concentration en calcium du muscle qui passe de 0.1 µmol/l à 0.1 mmol/l.
Enfin le calcium va agir avec les myofilaments épais et plus précisément la troponine C qui lorsqu’elle va se le lier avec les atomes de calcium va changer sa configuration et ainsi démasquer les sites de liaison sur l’actine des têtes de myosine. La contraction musculaire s’active alors, les têtes de myosine qui étaient auparavant couplées avec de l’ADP et du phosphate inorganique ou Pi(HPO₄2⁻) et situées à 90° avec les myofilaments d’actine vont se lier à l’actine elle-même et libérer l’ADP et le Pi permettant de diminuer l’angle entre les têtes de myosine et l’actine de 45°.
Pour cela la réaction suivante est primordiale :
ATP + eau → ADP + Pi
C10H16N5O13P3 4- + H2O = C10H15N5O10P2 2- + HPO4 2- + 2H+
1) Schéma de la liaison tête de myosine avec le myofilament d'actine:
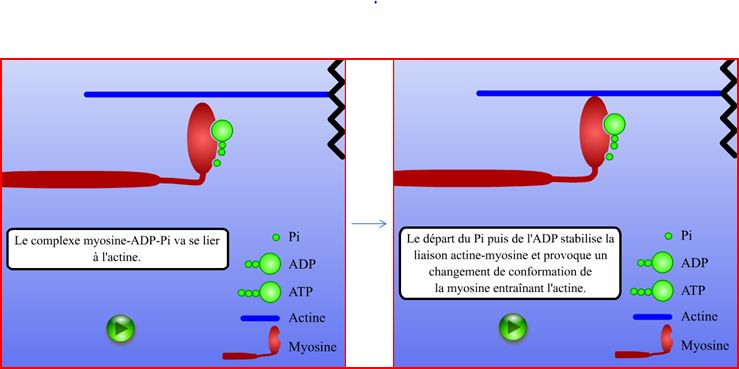
Par la suite de l’ATP va se coupler avec les têtes de myosine détruisant la liaison actine-myosine.
2) Schéma du changement de l'angle entre la tête de myosine et le myofillament d'actine et de la séparation des têtes de myosine et de l'actine:
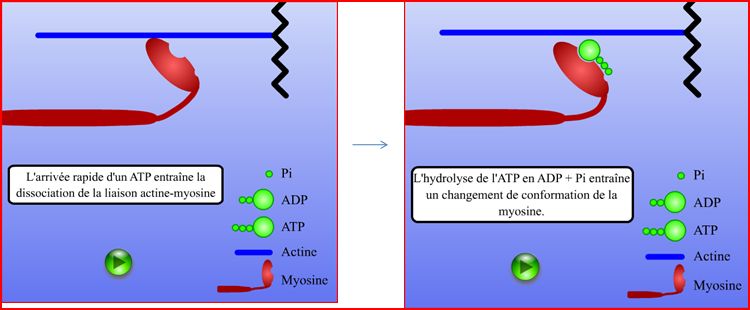
Puis la tête de myosine hydrolyse l’ATP en ADP et Pi subissant alors un changement de conformation qui permet de retrouver l’angle initial entre les têtes de myosine et l’actine mais aussi une légère avancée du myofilament de myosine vers la strie Z du sarcomère correspondant à un raccourcissement de celui-ci. Ce cycle de 15 µm /sec. Cela permet à l’échelle du muscle, grâce au nombre de sarcomère, de le raccourcir de plusieurs centimètres.
3) Schéma du l'avancée des têtes de myosine:
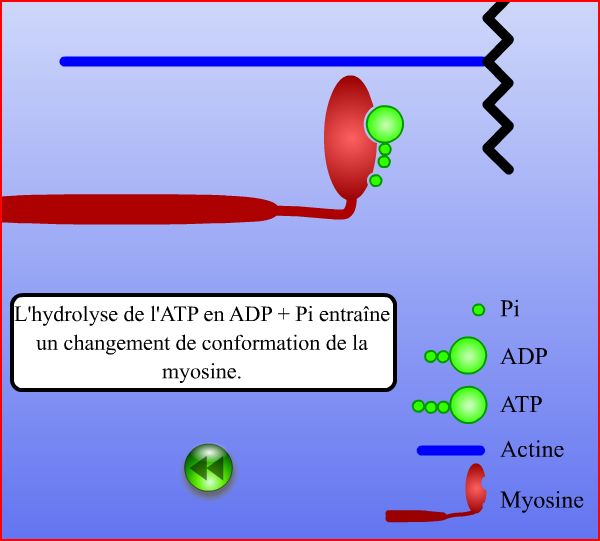
Enfin l’organisme stoppe le cycle par diminution de la concentration en calcium.
2/ La synthèse d'ATP:
Introduction:
L’ATP existent en très faible quantité dans le corps humain seulement 4.5 mmol.kg⁻¹ du muscle, sachant qu’un homme moyen de 70 kg possède 30 kg de muscle ; donc dans son corps il y aura 4.5×30=0.1350 mol d’ATP.
Le sprinteur va donc avoir besoin de synthétiser cette molécule car une poignet de centième de seconde après le départ du sprint l’ATP sera entièrement consommé par les myofibrilles.
Pour cela il existe 3 voies, 3 filières :
• La filière anaérobie alactique qui correspond à l’emploi de la phosphocréatine des muscles et qui est majoritairement utilisé lors du 100 m.
• La filière anaérobie lactique qui correspond à la suite de 2 processus biologiques la glycolyse et la cycle de Krebs et permettant la production de la molécule d’ATP et de 4 NADH ( C21H28N1O14P12 2-)
• La filière aérobie alactique qui grâce à l’oxygène et au coenzyme NADH+ et FADH2 va produire 34 molécules d’ATP ou 32 selon la navette utilisé.
a) La filière anaérobie alactique:
Celle-ci comme le souligne le tableau est le plus utilisé lors d’un 100m. Un sprinteur va ainsi reconstituer immédiatement les molécules d’ATP hydrolysée en ADP et HPO4 2- grâce à la phosphocréatine PC contenu dans les muscles. Cette réaction est catalysée pat l’enzyme centrophosphokinase et peut être résumé par l’équation suivante :
• ADP + PC → ATP + créatine
C10H15N5O10P2 2- + C4H10N3OP- → C10H16N5O13P3 4- + C4H9N3O2 +
1) Schéma de la filière anaérobie alactique:

Il y a donc transfert du groupe phosphate de la phosphocréatine à l’ADP pour former de l’ATP. Très rarement une réaction s’effectue afin de réguler la quantité d’ADP dans le muscle.
2 ADP → ATP + AMP
Cependant les réserves de phosphocréatine ne sont pas infinies dans le muscle et sont entièrement consommées au bout de 10 s. Une autre filière prend ainsi le relais la filière anaérobie lactique.
b) La filière anaérobie lactique:
Introduction à la glycolise:
La glycolyse, ou voie d’Embden-Meyerhof-Parnas, se déroule dans le cytoplasme et produit à partir du glucose, du pyruvate.Pour une molécule de glucose, 2 molécules de pyruvate sont donc produites ainsi que 2 NADH et 2 ATP.
L’ensemble des réactions peut-être simplifié en :
Glucose + 2 ADP + 2 Pi + 2H+ + 2 NAD+ → 2 pyruvates + 2 ATP + 2NADH + H+ +2H2O ( ceci est une représentation sympbolique des réactions et ne correspond pas une équation chimique )
Avec des phosphorylations d’ATP
2ADP + 2 Pi + 2 H+ → 2 ATP + H2O
2 ( C10H15N5O10P2 2-) + ( HPO4 2-) + 2 H+ → ( C10H16N5O13P3 4-) + H2O
Couplées avec l’oxydoréduction du coenzyme NAD+
NAD+ + 2H+ + 2 e⁻ → NADH + H+ avec le couple NAD+/NADH
C21H27N7O14P12 - + 2H+ + 2e- → C21H28N7O14P12 2- + H+
Nous allons donc présenter les dix étapes de ce processus biologique ( la glycololyse ) permettant de produire deux molécules d'ATP:
1. La Phosphorylation du glucose en glucose-6-phosphate :
Cette réaction irréversible permet aux cellules d’emmagasiner plus de glucose en formant du G6P dans le cytoplasme car la membrane plasmique n’a pas de transporteur pour cette molécule. Cette réaction est catalysée par 2 enzymes différents selon la quantité de substrats disponibles : l'hexokinase pour des quantités plutôt faibles et la glucokinase lorsqu’il y a de fortes concentrations en glucose comme après un repas. La molécule d’adénine triphosphate est elle aussi nécessaire à cette réaction car c’est elle qui, sous l’action de l’enzyme , cède un phosphate HPO4 2⁻ au glucose. Cependant cette réaction n’intervient pas seulement dans la glycolyse mais peut aussi servir à d’autres voies biologiques.
Donc l’équation de cette étape est :
Glucose + ATP → ADP + H+ + G6P
2. L’isomérisation du glucose-6-phosphate en fructose-6-phosphate:
Lors de cette réaction il est synthétisé à partir du G6P : C6H13O9P 2- , du fructose -6-phosphate: C6H13O9P 2- c'est-à-dire que d’un point de vue des formules cette réaction ne change rien mais permet d’obtenir un isomère de G6P avec une formule développée différente. Cette réaction est catalysée par l’enzyme glucose-6-phosphate isomérase ou aussi appelé phosphoglucose isomérase.
3. Phosphorylation du fructose-6-phosphate en fructose-1.6-diphosphate:
Cette étape est essentielle car elle permet une véritable régulation de la vitesse de la glycolyse. Tout d’abord celle-ci par l'hydrolyse d’ATP (adénine triphosphate) est irréversible. De plus la concentration de cette molécule modifie l’efficacité de cette réaction. En effet plus la concentration d’ATP est forte dans le cytoplasme plus l’activité de l’enzyme catalysant cette réaction sera faible car l’ATP agit par allostérie sur la phosphofructokinase c'est-à-dire que l’ATP modifie la structure spatiale de cette enzyme entrainant la modification du site actif et de liaison de celle-ci. Le Fru-6-P n’est alors plus synthétisé en Fru-1.6-DP mais en Fru-2.6-DP ne jouant aucun rôle dans le métabolisme. Le fructose-2.6-DP a pour unique but de rétablir par allostérie au contraire de l’ATP la synthèse de Fru-1.6-DP. Dans cette réaction l’ATP cède un groupement phosphate au Fru-6-P pour former le Fru-1.6-DP cette dégradation produit aussi de l’ADP et un ion H+.
Réaction : Fru-6-P + ATP →ADP +Fru-1,6-DP + H+
Donc depuis le début de la glycolyse on a consommé déjà 2 ATP, la glycolyse semble donc en attendant énergivore.
4. Séparation du fructose-1.6-diphosphate:
Le Fru-1.6-DP est séparé en deux (cliver) par un enzyme l’aldolase qui appartient à la classe des lyases. Ces enzymes sont rassemblés dans une classe car ils n’utilisent ni l’oxydation (transfert d’électron entre un oxydant d’un couple et le réducteur d’un autre couple) ni l’hydrolyse (dégradation d’une molécule grâce aux ions oxoniums H3O+ et hydroxyde HO- provenant de la séparation de l’eau H2O : 2H2O→H3O+ +HO-) pour séparer une molécule en deux. On obtient alors du glycéraldéhyde-3-phosphate (G-3-P) et de la dihydroxyacétone phosphate : DHAP .
5. Isomérisation de DHAP en G-3-P:
Cette réaction par l’action d’un enzyme le triose phosphate isomérase transforme le DHAP (C3H7O6P 2-) en isomère le G-3-P (C3H7O6P 2-) permettant d’obtenir à partir du clivage du Fru-1.6-DP deux G-3-P.
6. Phosphorylation des deux glycéraldéhyde-3-phosphate en 1.3 diphosphoglycérate:
Cette réaction est permise par l’oxydoréduction de NAD+ en NADH mais aussi grâce à la présence de groupement phosphate : Pi dans le cytoplasme qui vient équilibrer l’équation.
G-3-P+ NAD+ + Pi → NADH + H+ + 1,3 DPG
Cette réaction catalysée par la glycéraldéhyde-3-phosphate déshydrogénase, est l’unique étape de la glycolyse permettant la production de 2 NADH qui seront utilisé plus tard dans la chaine respiratoire pour produire de l’ATP lors de la phosphorylation oxydative.
7. Production de 2 ATP lors de la transformation de 2 :1.3-diphosphoglycérate en 2 :3-phosphoglycérate :
En effet cette réaction catalysée par l’enzyme 3-phosphoglycérate kinase fait réagir un groupement phosphate du 1.3-DPG avec de l’adénine di phosphate ADP pour produire de l’ATP.
1,3-DPG + ADP → ATP + 3PG
Au cours de cette réaction le énergétique devient nulle car elle produit 2 ATP qui contrebalance l’utilisation des ATP lors de la 1ére phase.
8. Isomérisation de 3-PG en 2-PG:
Cette réaction transforme, par l’action de l’enzyme phosphoglycérate mitose, le 3-PG (C3H7O7P 2-) en isomère 2-PG de même formule brute (C3H7O7P 2-).
9. Séparation du 2 - PG en phosphoénolpyruvate et eau:
Cette réaction est catalysée comme la quatrième étape par une lyase : l'énolase ,elle nécessite la présence d’ions Mg 2+ comme second catalyseur. Elle clive donc 2-PG en phosphoénolpyruvate ( PEP ) et eau.
2-PG → PEP + eau
10. Production de 2 ATP en transformant 2 phosphoénolpyruvates en pyruvate:
Le groupe phosphate Pi est transféré du phosphoénolpyruvate à l’ADP ; cette réaction est catalysée par un pyruvate kinase ; la présence d’ions H+ est aussi indispensable à cette réaction pour former l’ATP.
PEP + ADP + H+ → pyruvate + ATP
Cette réaction permet donc de produire deux molécules d'ATP vu qu'il y avait deux PEP à l'origine.
Bilan:
La glycolyse devint donc productrice d’énergie car après cette dernière réaction le bilan final est :
A partir d’ 1 molécule de glucose on va consommer:
- 2 molécules de NAD+
- 2 molécules d’ADP
- 2 molécules de HPO4 2-
Afin de produre:
- 2 molécules de pyruvate
- 2 molécules de NADH
- 2 molécules d’ATP
- 2 molécules d’eau
Introduction au cycle de krebs:
Apres la glycolyse un nouveau processus apparait dans cette filière: le cycle de Krebs. Celui-ci est appelé cycle car le produit de la dernière réaction, l’acide oxaloacétique est utilisé dans la première réaction. Ce processus a lieu dans la matrice mitochondriale.
1) Schéma d'une mitochondrie:

Cependant avant de reprendre la suite de la glycolyse, les 2 acides pyruviques qui ont été créés vont être oxydés en acétyle-COA par un complexe enzymatique la pyruvate déshydrogénase et met en jeu de nombreux coenzymes comme NAD+,HSCoA….
Cette réaction peut être symbolisée par :
Acide pyruvique + NAD+ + HSCoA → acétyle-CoA + NADH + H+ +CO₂
En effet lors de cette réaction 2 coenzymes NADH sont produits ceci permettant d’alimenter la phosphorylation oxydative.
Une fois les 2 acétyle-CoA formés, ils vont être transférés jusqu’à la matrice mitochondriale où le cycle de Krebs va véritablement commencer.
1.formation du citrate:
Cette étape s’effectue en deux phases et est catalysée par l’enzyme citrate synthétase une liase qui lors de cette réaction va rassembler 2 molécules au lieu dans séparer une en 2 .En effet ici cette enzyme va rassembler 2 oxalocitrates avec 2 acétyle-CoA pour former du citroyl-CoA.
2 acétyle-CoA + 2 oxaloacétate → 2 citroyl-CoA
Ces molécules ( citroyl-CoA ) vont être ensuite, en présence d’eau, hydrolysées pour donner 2 citrates.
2.isomérisation du citrate en iso citrate:
Le citrate obtenu va tout d’abord être déshydraté c'est-à-dire qu’on va lui enlever une molécule d’eau. On obtient du cis-aconitate qui lui va être réhydraté c'est-à-dire que l’on va le faire réagir avec une molécule d’eau afin de produire un isomère du citrate de l’iso citrate. Cette réaction est elle aussi catalysé par une lyase : la cis-aconitase. Lors de l’hydratation et de la déshydratation un ion H+ est mis en jeu d'abord comme substrat puis comme produit .
citrate + H+ → cis-aconitate+ eau puis cis-acocinate+eau→ iso citrate + H+
3.oxydation de l’iso citrate:
Cette réaction d’oxydoréduction catalysée par l’enzyme iso citrate déshydrogénase transforme l’iso-citrate en oxalosuccinate en se combinant avec le couple NAD+/NADH et en libérant un ion H+.
iso citrate + NAD+ → oxalosuccinate + NADH + H+
Cette réaction permet donc de produire de nouveau 2 NADH qui vont être réutilisés dans la filière aérobie a lactique.
4.décarboxylation de l’oxalosuccinate:
Lors de cette réaction du CO2 est produit, en effet l’oxalosuccinate va donner , grâce à l’action de l’enzyme iso citrate déshydrogénase, de l’α-cétoglutarate mais aussi et surtout du CO2.
oxalosuccinate → α-cétoglutarate + CO2
5.déshydrogénation de l’α-cétoglutarate:
C’est la seconde réaction de ce cycle qui permet la production de 2 NADH qui comme nous l’avons évoqué auparavant va servir à produire des molécules d’ATP grâce à la phosphorylation oxydative. Cette réaction est catalysée par un complexe enzymatique l’α-cétoglutarate déshydrogénase mettant en jeu de nombreux coenzymes en plus du NAD+, le TPP, lipoate, HSCoA, FAD. Le produit de cette réaction est le succynil-CoA.
Elle peut-être sympboliser par α-cétoglutarate + NAD+ + HSCoA → succynil-CoA + NADH + H+ + CO2
6.formation de succinate:
Cette réaction catalysée soit par l’enzyme succynil-CoA synthétisé, soit par la succinate thiokinase, va permettre, en présence de succynil-CoA ,d’un groupement phosphate Pi, d’eau et de GDP : guanosine di phosphate de produire du succinate, du coenzyme A: HSCoA et du GDP : guanosine triphosphate. Cette dernière molécule va s’hydrolyser en présence d’ADP et d’eau à l’aide de l’enzyme GTPase et ainsi donner une molécule d’ATP.
succynil-CoA + Pi + eau + GDP → succinate + HSCoA + GDP
Donc lors de cette réaction 2 molécules d'ATP vont être produites.
7.déshydrogénation de succinate en fumarate:
Cette réaction amène, à partir de succinate et du coenzyme: l’ubiquinone CoQ, à la production de fumarate et d’ubiquinol CoQH2. Lors de cette réaction l’enzyme succinate déshydrogénase va aussi employer le coenzyme FAD qui va donner du FADH2, pouvant être aussi utilisé lors de la phosphorylation oxydative.
succinate + CoQ + FAD → fumarate + CoQH2 + FADH2
8.l’hydratation du fumarate en malate:
Cette réaction catalysée par l’enzyme fumarase ou fumarate hydrolase fait réagir de l’eau avec le fumarate afin de donner du malate.
fumarate + eau → malate
9.déshydrogénation (oxydation) du malate en oxaloacétate:
Cette dernière réaction catalysée par une malate déshydrogénase transforme le malate en oxaloacétate à travers la transformation du NAD+ en NADH + H+.
malate + NAD+ → oxaloacétate + NADH + H+
Bilan:
Le cycle de Krebs se boucle ainsi :les 2 molécules d’oxalo cétate produites à la 9éme étape sont réutilisées au niveau de la première étape.
D’un point de vue énergétique : à partir des 2 acides pyruviques obtenus après la glycolyse on a produit 2 ATP, 6 NADH et 2 FADH2.
Ce cycle a aussi produit des ions hydrogène, 4 molécules de CO2, 2 molécules de CoQH2 et cela en consommant en plus de l’acide pyruvique, 6 NAD+, 2 GDP, 2 Pi, 4 H2O et 2 CoQ.
c) La filière aérobie alactique ou phosphorylation oxydative
Tout d'abord on peut se demander si cette filière joue un rôle dans la synthèse d'énergie lors d'un 100 m ?
Autant il est facile d’admettre que la filière anaérobie lactique joue un rôle dans un 100 m comme le souligne le tableau ci-dessous, autant la filière aérobie alactique ne semble pas influer en quoi que ce soit dans cette épreuve sportive car son temps d’activation est souvent placé autour de 3 min d’effort. Nous allons donc à travers une expérience tenter de justifier l’action même minime de cette filière sur le 100 m couru autour des 10 secondes.
1) Tableau du pourcentage de la synthèse d'ATP permise par chaque filière dans plusieurs discipline dont le 100m:
Le bleu représente la filère anaérobie alactique, le jaune la filière anaérobie lactique et le violet la filière aérobie alactique.

2) Schéma de la puissance de l'énergie fournie par les différentes filières en fonction du temps:

Hypothèse : La filière aérobie alactique joue un rôle lors du 100 m
Conséquence vérifiable : La consommation de dioxygène du corps humain , nécessaire à cette filière va augmenter avant le seuil de 3 min et notamment lors des 1éres secondes d’effort.
Protocole : Tout d’abord la personne utilisée pour cette expérience est Nathan il pèse 60 kg, mesure 1m73 et pratique une activité sportive régulière.
Premièrement on mesure pendant 3 min la consommation de dioxygène de Nathan au repos grâce au logiciel exao.
Puis on remesure la consommation en dioxygène de Nathan lors d’un effort physique correspondant à une flexion toutes les deux secondes grâce au même logiciel.
On obtient ainsi deux courbes :
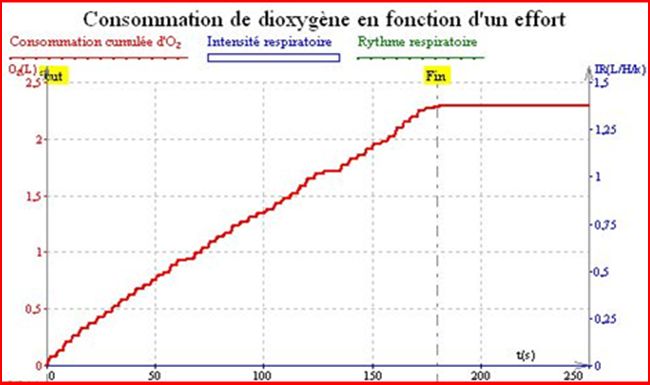
1) Graphique de la consommation cumulée en dioxygène de Nathan en fonction du temps et cela au repos:
2) Graphique de la consommation cumulée de dioxygène de Nathan en fonction du temps et cela lors d'un effort intense:
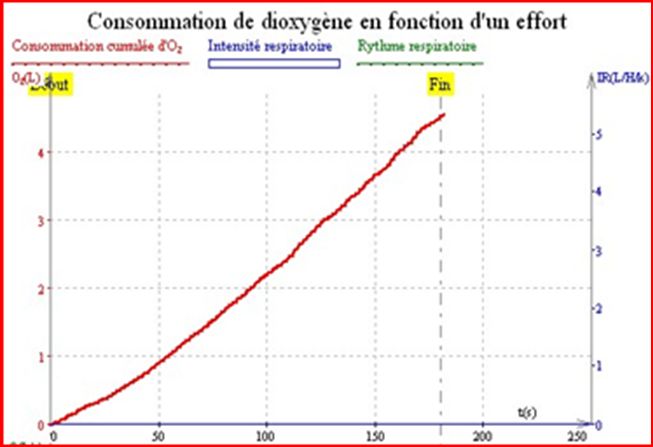
Sur ces courbes on mesure la consommation cumulée d’O2 en L en fonction du temps en s, au repos ou lors d’un effort physique.
Tout d’abord on observe que au temps 180 s la consommation cumulée en O2 lors d’un effort est déjà hautement supérieure à celle au repos : 4,5 L en effort et 2,25 L au repos.
Donc lors d’un effort la consommation de dioxygène élément nécessaire à la phosphorylation oxydative, augmente avant le seuil supposé de 3 min d’activation de cette filière.
De plus on observe qu’après un temps de seulement 50 s la consommation cumulée d’O₂ lors d’un effort : 1 L est déjà supérieure à celle au repos : 0,75 L.
On en déduit que très tôt la consommation d’O₂ du corps humain augmente lors d’un effort.
Il est en conclusion grandement probable que malgré le faible temps du 100m la filière aérobie alactique permet pour une infime partie l’approvisionnement en ATP des muscles.
Le fonctionnement de cette filière :
La phosphorylation oxydative est la filière énergétique permettant la production de la majorité des molécules d’ATP, elle est la dernière étape de la chaine respiratoire après la glycolyse et le cycle de Krebs.
La phosphorylation oxydative est un processus biologique ayant lieu dans la matrice mitochondriale c'est à dire à l'intérieur de la mitochondrie, elle met en jeu des protons et les deux types de coenzymes produisent au cours du cycle de Krebs et de la glycolyse : le NADH e le FADH , qui vont être oxydés au cours de ce processus.
En effet divers complexes situés dans la membrane mitochondriale permettent le transfert de protons de la matrice à l'espace inter membranaire créant ainsi un gradient de protons qui va activer l'enzyme ATP synthétase.
Les deux électrons des coenzymes sont tout d'abord transférés à un premier complexe enzymatique qui agit comme NADH coenzyme Q réductase pour les molécules de NADH et qui va transférer deux protons de la matrice à l'espace inter membranaire. Pour les molécules de FADH₂ le premier complexe agissant se nomme : succinate Q réductase captant les deux électrons du FADH2 mais ne permettant le transfert d’aucun proton.
Par la suite le coenzyme ubiquinone permet le transfert des deux électrons qu’ils proviennent du NADH ou du FADH2 vers le complexe enzymatique suivant : le coenzyme Q cytochrome C réductase.
Ce complexe permet de transférer deux protons un pour chaque électron de la matrice mitochondriale à l’espace inter membranaire.
Un autre coenzyme cytochrome C permet le transfert des électrons jusqu’au dernier complexe enzymatique le cytochrome C oxydase.
Ce complexe va à partir des deux électrons initiaux, d’une molécule de dioxygène et de 4 protons produire une molécule d’eau et transférer deux protons.
C’est donc pour cette étape que l’augmentation de dioxygène est nécessaire.
Après ces différentes étapes une forte concentration de protons se développe dans l’espace inter membranaire alors que la concentration diminue dans la matrice, un gradient se crée.
Ceci va ainsi permettre l’activation de l’enzyme ATPase qui fonctionne comme une pompe ionique et qui rééquilibre la concentration en protons entre la matrice et l’espace inter membranaire. Cette enzyme est composée de deux sous-unités l’une retransférant les protons et l’autre synthétisant de l’ATP à partir de Pi et d’ADP. Les 6 protons obtenus à partir d’une molécule de NADH permettent de produire 3 ATP et les 4 obtenus grâce à une molécule de FADH2 produisent 2 ATP.
Enfin l’utilisation d’un certain type de navette du cytoplasme à la matrice mitochondrial peut influer sur la production d’ATP car on aura soit du NADH soit du FADH2.
Vidéo récapitulative de la phosphorylation oxydative en anglais ( le texte ci-dessus permet la cmopréhension de la vidéo sans le son ):
Bilan
Donc avec les 8 NADH et les 2 FADH2 on obtient un total de 28 molécules d'ATP ce qui fait en somme pour l'ensemble de la chaine respiratoire on arrive à 32 molécule d'ATP ptoduites.